- The University
- Studying
-
Research
- Profile
- Infrastructure
- Cooperations
- Services
-
Career
- Med Uni Graz as an Employer
- Educational Opportunities
- Work Environment
- Job openings
-
Diagnostics
- Patients
- Referring physicians
-
Health Topics
- Health Infrastructure

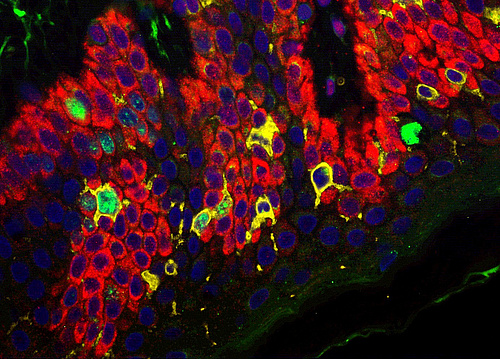
Immunsystem: Dendritische Zellen im Fokus
Das Immunsystem muss täglich Höchstleistungen erbringen, um den Körper vor Erkrankungen zu schützen. Dendritische Zellen (DCs) sind hochspezialisierte Abwehrzellen des Körpers und gelten als zelluläre Außenposten des Immunsystems. Wissenschafter*innen der Med Uni Graz haben untersucht, wie das Immunsystem gleichzeitig harmlose Zellen tolerieren und Immunität gegenüber Pathogenen bewerkstelligen kann. Die Ergebnisse wurden aktuell im international renommierten Journal „Cell Reports“ veröffentlicht.
Außenposten des Immunsystems im Visier der Forschung an der Med Uni Graz
Dendritische Zellen kommen in vielen Organen und Geweben vor. Gewisse Subtypen von DCs in Epithelien (Oberhaut, Schleimhäute in Darm und Lunge) verhindern überschießende Immunreaktionen gegen nützliche Mikroben und Substanzen aus der Umwelt, die wir beispielsweise über Nahrungsmittel zu uns nehmen. Sie sind mit einer Vielzahl von Rezeptorstrukturen für Umweltmoleküle und Mikroben ausgestattet und in der Lage, in lymphatisches Gewebe zu wandern, wo sie antigenspezifische T-Zell-Antworten auslösen und die Immunantwort unterdrücken bzw. Immuntoleranz erzeugen können. Diese Art von dendritischen Zellen wird auch als regulatorische oder tolerogene DCs bezeichnet, im Gegensatz dazu stehen entzündliche bzw. immunogene DCs, die in der Lage sind, eine protektive bzw. schützende Immunantwort auszulösen. Am Otto Loewi Forschungszentrum der Med Uni Graz zielte eine Studie rund um Herbert Strobl, Inhaber des Lehrstuhls für Immunologie und Pathophysiologie, und PhD-Studentin Victoria Zyulina in enger Kooperation mit Jose M. Silva, Icahn School of Medicine at Mount Sinai, New York, darauf ab, jenen Mechanismus aufzuklären, welcher der Entwicklung von DCs mit tolerogenen versus immunogenen Eigenschaften zugrunde liegt.
Erforschung der Helfer des Immunsystems: Mechanismen noch weitgehend unbekannt
Zum Schutz der Gesundheit bilden Immunantworten in der Regel eine wirkungsvolle Barriere gegen Pathogene. Richtet sich die Immunantwort jedoch gegen harmlose Antigene oder werden ungeeignete oder zu starke Abwehrreaktionen aktiviert, resultieren überschießende Reaktionen des Immunsystems, die sich beispielsweise in Allergien, Autoimmunerkrankungen oder chronisch entzündlichen Darmerkrankungen bemerkbar machen. Wie DCs mit Umweltsignalen interagieren, um eine angemessene Immunantwort auf Krankheitserreger zu entwickeln und gleichzeitig unangemessene bzw. überschießende Immunantworten zu verhindern, ist noch wenig erforscht. „Wir wissen, dass DCs dafür verantwortlich sind, dass effektive Immunantworten gegen Mikroben wie z.B. gefährliche Viren zustande kommen. Dies schafft der Körper einerseits durch die Bildung spezialisierter DC-Subsets, andererseits durch biochemische Signale“, beschreibt Herbert Strobl das Forschungsgebiet. In den Epithelien der Haut und Schleimhäute kommen sogenannte Langerhans-Zellen (LC) vor, ein Subtyp von Immunzellen, der u.a. tolerogene Eigenschaften sowie die Fähigkeit zur Selbsterneuerung besitzt. In darunterliegenden Geweben und in entzündlichen Läsionen befinden sich auch Zellen mit entzündungsfördernden Eigenschaften, sogenannte moDC, also von Monozyten abgeleitete dendritische Zellen.
Bedeutung von microRNAs: Regulierung der Prozesse in Zellen und Geweben
RNA Moleküle sind von großer Bedeutung für die Biosynthese von Eiweißmolekülen. Eine medizinische Anwendung Protein-kodierender RNA Moleküle gelang unlängst in der Impfstoffentwicklung gegen COVID-19. RNA Moleküle können aber auch negativ-regulatorische Effekte zeigen. Für die Entdeckung des Prozesses der „RNA Interferenz“ wurde 2006 sogar ein Nobelpreis vergeben. Während der letzten 20 Jahre stellte sich heraus, dass viele wichtige biologische Prozesse in Zellen und Geweben durch sogenannte microRNAs - kleine nicht-kodierende RNAs – reguliert werden. Ein Mangel in der Biosynthese dieser microRNAs führt zu einer fehlgesteuerten Entwicklung und Funktion der DCs. Die Forscher*innen konzentrierten sich auf die molekularen Mechanismen, die durch spezifische microRNAs in der DC-Subset-Entwicklung reguliert werden. Konkret suchten sie nach microRNAs, die von den oben genannten DC-Subsets (LC versus moDC) gebildet werden. Es zeigte sich, dass miR-424(322)/503 in entzündungsfördernden moDCs im Vergleich zu LCs stark hochreguliert ist. „Mittels Gentransfertechniken stellten wir fest, dass miR-424(322)/503 für die Entwicklung von moDC entscheidend ist. Umgekehrt war die Entwicklung von LCs von einem miR-424(322)/503-Mangel nicht eingeschränkt“, erklärt Herbert Strobl. Zudem waren moDCs-Subgruppen in der Haut von Mäusen mit fehlendem miR-424 (322)/503 unter entzündlichen Bedingungen im Vergleich zu normalen Mäusen signifikant reduziert. „Die Daten bestätigten unsere Studien mit menschlichen Zellen, die zeigten, dass die Differenzierung von moDCs im Gegensatz zu LCs von miR-424 (322)/503 abhängig ist“, so Victoria Zyulina.
Gencluster reguliert pro- vs. anti-inflammatorische DC-Subset-Differenzierung
Schließlich stellten die Wissenschafter*innen fest, dass Gene im TGF-β-Signalweg in DC Vorläuferzellen hochreguliert sind. In Übereinstimmung damit begünstigt der Verlust von miR-424/503 in DC Vorläuferzellen die TGF-β1-abhängige LC-Differenzierung auf Kosten der moDC-Differenzierung. „Daher schlugen wir ein Modell vor, bei dem miR-424(322)/503 als molekularer Schalter fungiert, welcher mittels Modulation der TGF-β-Signalübertragung darüber entscheidet, ob tolerogene/anti-entzündliche LCs oder entzündungsfördernde moDCs gebildet werden“ so die Forscherin. Die Aufklärung dieses Mechanismus trägt zum Verständnis bei, wie unser Immunsystem gleichzeitig Toleranz gegenüber harmlosen Molekülen und Mikroben und Immunität gegenüber gefährlichen Pathogenen bewerkstelligen kann. Folgestudien werden zeigen, ob eine gezielte therapeutische Beeinflussung dieses Schalters eine Möglichkeit für die Regulierung fehlgesteuerter Immunreaktionen bei Allergien, Autoimmunerkrankungen und Malignomen darstellt.
Steckbrief: Herbert Strobl und Victoria Zyulina
Herbert Strobl arbeitet mit einer Vielzahl experimenteller Methoden an der Untersuchung des Immunsystems. Gemeinsam mit Victoria Zyulina, die nach ihrem Humanmedizinstudium in Russland das vom Wissenschaftsfonds FWF finanzierte PhD-Studium DK-MOLIN an der Med Uni Graz begonnen hat, will er durch ein besseres Verständnis dieser Prozesse zur Entwicklung neuer therapeutischer Strategien für Erkrankungen wie z.B. Autoimmunerkrankungen, Allergien und Krebs beitragen.
Kontakt
Univ.-Prof. Dr.
Herbert Strobl
Herbert Strobl
Lehrstuhl für Pathophysiologie und Immunologie
Otto Loewi Forschungszentrum
T: +43 676 7576 195
Kontakt
Dr.in
Victoria Zyulina
Victoria Zyulina
Lehrstuhl für Pathophysiologie und Immunologie
Otto Loewi Forschungszentrum
T: +43 316 38571164